Maddeden Gelen Enerji

Çekirdekte bulunan nötronlar, çekirdekteki parçacıkların bir arada durmasına yardımcı olmaktadır. Doğada aynı tür atomların çekirdeklerinde farklı sayıda nötron bulunabilmektedir. Çekirdeğinde farklı sayıda nötron bulunan aynı elementin atomlarına izotop (yerdeş) atomlar adı verilmektedir.
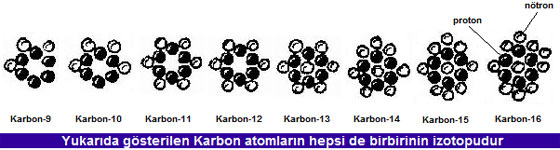
Örneğin Karbon atomu doğada aşağıdaki şekilde gösterilen 8 değişik izotop halinde bulunabilmektedir. Bu izotoplardan en hafifi olan Karbon-9'da 3 adet nötron bulunurken, en ağırı olan Karbon-16'da 10 adet nötron bulunmaktadır.
İzotop atomlar aynı elementin atomları olduğundan,
kimyasal özellikleri birbirinin aynıdır. Bütün karbon
izotopları kimyasal veya biyolojik olarak aynı şekilde
davranırlar. Vücudumuza giren karbon atomunun hangi
izotop olduğu, vücudumuz tarafından farkedilmez,
vücudumuz içindeki biyoloyik faaliyetlere aynı şekilde
katılırlar. İzotop atomlar, ağırlıkları farklı
olduğundan, ancak fiziksel olarak ayırt edilebilirler.
Her atom çekirdeği, çekirdeğinde belirli bir sayıda nötron olduğunda kararlı olabilmekte, nötron sayısı bu sayının altında veya üstünde olduğunda atom kararsız hale gelmektedir.
Örneğin
Karbon atomu, çekirdeğinde 6 veya 7 adet nötron
bulunduğunda kendini rahat hissedebilmekte, yani kararlı
olabilmektedir. Karbon atomunun diğer bütün izotopları
aşağıda da görüldüğü gibi kararsızdır. Kararsız olan
çekirdekler kendilerini büyük bir stres altında
hissederler. Bu streslerinden, dışarıya fazlalık
parçacık veya enerjiyi atarak kurtulmaya, yani kararlı
hale gelmeye çalışırlar.

Bu tür kararsız
çekirdeklere "ışınetkin (radyoaktif)" adı verimektedir.
Atomların çekirdeklerinde bulunan nötron sayısı, kararlı sayıdan ne kadar farklıysa, çekirdeğin kararsızlığı o kadar fazladır. Örneğin yukarıdaki Karbon-9 ve Karbon-16 için kararsızlık artık dayanılmaz hale gelmiştir. Bu çekirdekler her an enerji veya parçacık atarak rahatlamaya çalışabilirler.
 Doğada
bulunan bütün atomların faklı izotopları bulunmaktadır.
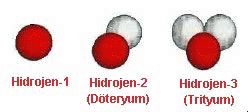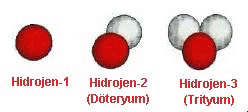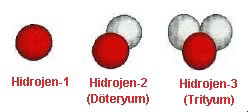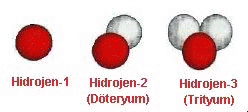
Yanda hidrojen atomunun tanınmış üç izotopu
görülmektedir. İlki bildigimiz hidrojen atomudur ve
çekirdeğinde sadece bir adet proton bulunmaktadır.
İkincisi çekirdeğinde bir proton bir de nötron bulunan
ve ağır suyu oluşturan hidrojen olarak da bilinen
döteryum izotopudur. Üçüncüsü ise çekirdeğinde bir
proton ve iki nötron bulunan trityum izotopudur.
Doğada
bulunan bütün atomların faklı izotopları bulunmaktadır.
Yanda hidrojen atomunun tanınmış üç izotopu
görülmektedir. İlki bildigimiz hidrojen atomudur ve
çekirdeğinde sadece bir adet proton bulunmaktadır.
İkincisi çekirdeğinde bir proton bir de nötron bulunan
ve ağır suyu oluşturan hidrojen olarak da bilinen
döteryum izotopudur. Üçüncüsü ise çekirdeğinde bir
proton ve iki nötron bulunan trityum izotopudur.
Hidrojen, helyum, karbon gibi küçük çekirdeğe sahip atomlar, çekirdeklerindeki proton sayısı ile nötron sayısı aşağı yukarı eşit olduğunda kararlı olabilmektedir. Örneğin şekilde gösterilen hidrojen atomu, çekirdeğinde hiç nötron bulunmadığında veya 1 adet nötron bulunduğunda kararlı olmaktadır. Dolayısıyla, Hidrojen-1 ve Hidrojen-2 kararlı iken, Trityum olarak bilinen Hidrojen-3, kararsız, yani ışınetkindir (radyoaktifdir).
Su molekülü 2 hidrojen ve 1 oksijen atomundan oluşmaktadır ve H2O formülü ile gösterilmektedir. Eğer su şekilde gösterilen Hidrojen-1'lerden oluşmuş ise bu suya "Normal Su", Hidrojen-2'lerden oluşmuş ise de "Ağır Su" adı verilmektedir. Her ikisi de nükleer teknolojide kullanılmaktadır.
Işınetkin (radyoaktif) maddelerin içinde kararsız çekirdekler bulunduğundan ve kararsız çekirdekler dışarıya parçacık veya enerji atarak kararlı hale gelmeye çalıştığından, ışınetkin maddeler tehlikeli olabilir. Dışarıya atılan parçacık ve enerji canlılara zarar verebilir.
Nükleer enerjinin hammaddesi olan Uranyum atomu doğada çoğunlukla 2 farklı izotop olarak bulunmaktadır. Bunlar aşağıdaki şekilde de gösterilen Uranyum-235 ve Uranyum-238 izotoplarıdır. Nükleer yakıt olarak kullanılan meşhur atom Uranyum-235 izotopudur. Fakat doğadaki Uranyum atomlarının ancak küçük bir bölümü Uranyum-235'den oluşmuştur. Doğadaki her 1000 Uranyum atomundan sadece 7 tanesi yakıt olan Uranyum-235 izotopu iken, büyük çoğunluğu olan 993 tanesi yakıt olmayan Uranyum-238 izotopudur.

Bu nedenle Uranyum'u madenden çıkarttıktan sonra nükleer yakıt olarak kullanabilmemiz için Uranyum-235 açısından zenginleştirmemiz gerekmektedir. Bu amaçla yakıt zenginleştirme tesisleri kurulmuştur.


